المحتوى
- 1 وضح البطارية الأساسية
- 2 حساب القوة الدافعة الكهربائية
- 3 الفرق المحتمل خلال تشغيل البطارية
- 4 الاستخدام الحالي
- 5 ـ العمل بالكهرباء
- وضح البطارية الأساسية
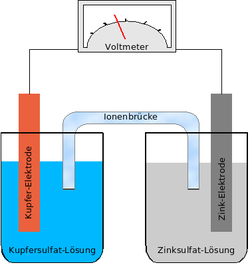
شكل الخلية الأصلية
تتكون الخلية الأولية من نصفين من الخلايا. في كل قطب كهربائي ، تختلف الأقطاب المعدنية عن بعضها البعض ، كما هو موضح في الشكل ، قطب واحد مصنوع من الزنك والآخر مصنوع من النحاس. اغمس كل منهم في أحد محاليل الملح: الزنك في محلول ZnSO4 وألواح النحاس في محلول CuSO4. الكيمياء هنا هي أن ذرات المعدن تميل لـ ترك المعدن ودخول المحلول ، وعندما تفعل ذلك ، فإنها تترك الإلكترونات على اللوحة وتدخل المحلول على شكل أيونات موجبة الشحنة. يتفاعل كل نصف من الوحدتين مع حلها. تم تسمية النظام على اسم الاختراع الأول لدانيال ، وتسمى الوحدة وحدة دانيال.
كما هو موضح في الشكل ، نجد أن ذرات الزنك تميل لـ دخول المحلول بدرجة أكبر من ذرات النحاس. أي أن تراكم الإلكترونات على صفيحة الزنك أكبر من تراكم الإلكترونات على لوحة النحاس. نظرًا لأن الإلكترونات مشحونة سالبًا ، فإن إمكانات لوحة الزنك أكبر من هذه الموجودة في لوحة النحاس. نظرًا لعدم وجود اتصال خارجي بين القطبين ، لا يوجد تدفق للتيار ولن تتحرك الإلكترونات.
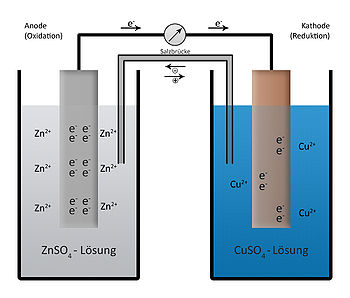
البطارية الكهروكيميائية (بطارية دانيال): يتم جمع المزيد من الإلكترونات على لوحة الزنك مقارنة باللوحة النحاسية
عندما نقوم بتوصيل القطبين خارجيا (كما هو موضح في الفولتميتر في الشكل) ، تبدأ الإلكترونات في الانتقال من القطب السالب Zn لـ القطب الموجب (الموجب) للنحاس. لأن الإلكترونات مشحونة سالبة ، يتم توليد تيار عكس اتجاه الإلكترونات. في نفس الوقت ، يتدفق تيار من الأيونات بنفس شدة التيار الخارجي عبر المحلول. لكل إلكترونين من قطب الزنك لـ القطب النحاسي في الدائرة الخارجية ، تدخل ذرات الزنك المحلول على شكل أيونات موجبة Zn2 + لتحل محل الإلكترونين الخارجين من لوحة الزنك من الخارج.
بحكم التعريف ، القطب الموجب هو القطب الذي يحدث فيه الأكسدة (فقدان الإلكترونات) ، لذلك ، في الخلية الجلفانية ، يمثل قطب الزنك الأنود. نظرًا لأن النحاس قد حصل على إلكترونين عبر التوصيل الخارجي ، فإنه سيوفر إلكترونين لأيونات النحاس Cu2 + من محلول كبريتات النحاس ، والذي يتم تحييده بواسطة أيونات النحاس ويترسب على الصفيحة النحاسية. بحكم التعريف ، فإن القطب السالب هو القطب الذي يخضع للاختزال (أي للحصول على الإلكترونات) ، والقطب النحاسي هو القطب السالب. تنتقل الإلكترونات من القطب الموجب لـ القطب السالب في الدائرة الخارجية.
حساب القوة الدافعة الكهربائية
يمكن تحديد فرق الجهد (القوة الدافعة الكهربائية) للبطارية باستخدام مقياس الفولتميتر الكهربائي القياسي لمكونات نصفي البطارية. وعند إجراء هذا التحديد ، نفترض أن التيار المار بين قطبي البطارية يساوي صفرًا.
نبدأ أولاً باختيار معدنين.في جهد القطب القياسي ، نبحث عن الجهد القياسي لمعدنين هØ يتم إعطاؤه بالفولت في الجدول. لذلك ، فإن فرق جهد البطارية يساوي ناتج الفولتية القياسية للجهاز.
على سبيل المثال ، في الصورة أعلاه ، لدينا حلان من كبريتات النحاس وكبريتات الزنك ، والصفيحة النحاسية مغمورة في كبريتات النحاس ، ولوحة الزنك مغمورة في محلول كبريتات الزنك. يوجد أيضًا جسر بين المحلين (يمكن استبداله بغشاء عازل بين المحلين) ، مما يسمح بتدفق SO42- أيونات من محلول النحاس لـ محلول الزنك (لذلك ، عندما يتم توصيل اللوحين من الخارج عبر الموصل ).
لدينا خليتان نصفيتان ، أحدهما للنحاس والآخر للزنك ، والتفاعلان الحاليان هما:
تشارك الأنود:
الزنك → Zn2 ++ 2e- (E = +0.76 V)
رد فعل كاثودي:
Cu2 + + 2e- → Cu (E = +0.34 V)
بالنسبة لنصف البطارية النحاسية ، نحصل على جهد تخفيض الكاثود E == +0.34 V أو جهد الأكسدة E == -0.34V.
بالنسبة لنصف بطاريات الزنك ، جهد أكسدة الأنود E == +0.76 V أو احتمال الاختزال E == -0.76 V
من السلسلة الكهروكيميائية في الجدول. بمعنى انتهاء ، رد الفعل الكلي الذي يحدث في الخلية هو:
نحاس + زنك ← نحاس + زنك +
بعد ذلك ، نحصل على فرق جهد البطارية بطرح القيم التالية: احتمال الأكسدة الأنوديك – احتمال الأكسدة الكاثودية (الكاثود)
+0.76 – (- V 1.100 = (0.34
أو من مجموع ما يلي: جهد تخفيض الكاثود (كاثود) – جهد تخفيض الأنود (مصعد)
+0.34 – (- V 1.100 = (0.76
أو من مجموع جهد أكسدة الأنود وإمكانية اختزال الكاثود: جهد أكسدة الأنود (مصعد) + جهد اختزال الكاثود (كاثود)
+0.34 + V 1.100 = 0.76
أي أن فرق جهد البطارية في حالة عدم وجود تيار خارجي هو 1100 فولت. هذا الجهد يسمى القوة الدافعة الكهربائية.
الاختلاف المحتمل عند تشغيل البطارية
العلاقة بين فرق الجهد والقوة الدافعة الكهربائية (EMF)
افترض أن بطارية E من E = 12 فولت ، ومقاومة الإدخال هي 2 أوم ، ومتصلة بمقاوم خارجي 6 أوم ومفتاح. تم فصل فرق الجهد بين طرف البطارية والمفتاح (لا يوجد تدفق تيار):
12 فولت = V = E.
فرق الجهد وإغلاق المفتاح: نحدد أولاً شدة التيار كماًا للعلاقة التالية:
أمبير (أنا = E ÷ (R + r
أين:
- القوة الدافعة الكهربائية للبطارية E.
- المقاومة الخارجية R
- مقاومة البطارية الداخلية
لذلك نحصل على التيار:
أمبير 1.5 = (أنا = 12 (6 + 2
ثم نحصل على فرق الجهد الخامس:
V = EI.r Volt 9 = 2.5 و V = 12-1
أي أن فرق الجهد بين أقطاب البطارية يزداد كلما كثرت المقاومة الخارجية. كلما اقتربت المقاومة الخارجية من اللانهاية ، كلما اقترب فرق الجهد من القوة الدافعة الكهربائية.
الاتجاه المعتاد للتيار
التيار الكهربائي هو تدفق الشحنة من القطب الموجب (الكاثود) لـ الكاثود (الأنود). هذا ما أطلق عليه العلماء منذ زمن طويل لأن اكتشاف التيار الكهربائي يسبق اكتشاف الإلكترونات ، لذلك يطلق عليه.
الاتجاه الطبيعي العادي: اتجاه التيار في الدائرة الخارجية من القطب الموجب لـ كاثود البطارية.
اتجاه الإلكترون: من سالب (غني بالإلكترون) لـ موجب (إلكترون فقير) خارج البطارية.
العمل بالكهرباء
العمل المنجز هو الشغل المطلوب لنقل مقدار 1 كولوم بين نقطتي اختلاف محتملتين. كماًا للعلاقة التالية ، يقاس العمل بالجول:
العرض = Q x V
أين:
عمل الجول
س هو الكولوم الكهربائي
فرق الجهد V
كماًا لهذه العلاقة ، يمكن تحديد الجهد:
“الجهد هو الفرق في الجهد بين نقطتين عندما يتطلب الأمر 1 جول من العمل لنقل 1 كولوم من الكهرباء من نقطة لـ أخرى.”
1 جول = 1 كولوم × فولت
- لاحظ أن وحدة الطاقة الكهربائية هي جول ، وهي نفس وحدة الطاقة الحرارية. كماًا للديناميكا الحرارية ، يمكن تحويل الطاقات المختلفة لـ بعضها البعض.